REPORTE DE CASO
ICTIOSIS ARLEQUIN, UNA GENODERMATOSIS DEVASTADORA
Fecha recibido: octubre 13 de 2017
Fecha aceptado: noviembre 11 de 2017
Felisa B. Carvajalino MDa, Laura F. Peña MDb
Correo electrónico autora principal Dra. Felisa B. Carvajalino: lfpena@fucsalud.edu.co
a Fundación Universitaria de Ciencias de la Salud, Bogotá D.C., Colombia.
b Laboratorio Clínico Especializado CIS. Ocaña Norte de Santander, Colombia.
RESUMEN
La ictiosis arlequín es la forma más grave y agresiva de las ictiosis congénitas. Es una rara entidad hereditaria, de patrón autosómico recesivo y su pronóstico es fatal en la mayoría de los casos; los neonatos por lo general mueren en los primeros días de vida por infección o deshidratación entre otras complicaciones. El diagnóstico prenatal sigue siendo difícil y el manejo adecuado podría aumentar la supervivencia. Presentamos a neonata con ictiosis arlequín nacida de madre con antecedente de feto arlequín.
Palabras clave: ictiosis arlequín, genodermatosis, autopsias.
© 2018 Fundación Universitaria de Ciencias de la Salud - FUCS.
Este es un artículo Open Access bajo la licencia CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/4.0/).
ABSTRACT
Harlequin ichthyosis is the most severe and aggressive presentation of congenital ichthyosis. It is an extremely rare autosomal recessive genetic disorder with a fatal outcome in most cases; harlequin infants usually die in the first few days of life secondary to infection and dehydration among other complications. Prenatal diagnosis remains difficult and adequate care may enhance survival. We report a female harlequin infant born to a mother with a history of harlequin fetus.
Key words: harlequin ichthyosis, genodermatosis, autopsies.
© 2018 Fundación Universitaria de Ciencias de la Salud - FUCS.
This is an open access article under the CC BY-NC-ND license ( ñhttp:// creativecommons.org/licenses/by-nc-nd/4.0/).
Descripción del caso
Neonata de 32 semanas de gestación y 1300 gramos de peso. El parto fue por cesárea debido a estado fetal insatisfactorio. La niña presentaba grandes placas queratósicas, duras, gruesas y de coloración amarillenta, separadas por fisuras profundas de fondo eritematoso que comprometían toda la superficie corporal (figura 1). También había ectropión, eclabium, hipoplasia de puente nasal y de los pabellones auriculares y deformidad en manos y pies con hipoplasia de uñas (figura 2). Se mantuvo a la paciente en unidad de cuidados intensivos neonatal con soporte de oxígeno por cámara cefálica con nutrición enteral, retinoides, antibioticoterapia y vaselina. Al tercer día de vida se produjo el fallecimiento precedido de un empeoramiento de su estado general con episodio de bradicardia y desaturación sin respuesta a las maniobras de reanimación. La madre había presentado 3 años atrás en su primer embrazo producto de gestación de similares características con diagnóstico por autopsia clínica de ictiosis arlequín (figura 3).
Discusión
El feto arlequín es la forma más grave y agresiva de las ictiosis congénitas. El primer caso fue descrito por el reverendo Oliver Hart en 1750.1 Aproximadamente 200 casos de ictiosis arlequín han sido publicados. Según la literatura científica para el 2007, se habían reportado 101 casos en todo el mundo en la literatura médica. La incidencia está calculada en 1 por 300.000 nacimientos.2 Se trata de una entidad de herencia autosómica recesiva, causada por la mutación del gen ABCA12 (adenosine triphosphatebinding cassette A12), que resulta en el transporte defectuoso de lípidos, alteración que impacta de manera significativa el desarrollo normal de la piel.3 Los bebés suelen nacer prematuros y están “encerrados” en un estrato córneo engrosado que a menudo se describe como armadura. Después del nacimiento se producen fisuras rojas en estas placas duras e inflexibles que se extienden hasta la dermis resultando en una piel parecida a un comodín. Los lactantes podrían tener microcefalia, ectropión y eclabio.4 El conducto auditivo externo y las fosas nasales aparecen rudimentarios e inmaduros.5 Además, tienen insuficiencia respiratoria como resultado de la expansión torácica restringida y deformidades esqueléticas. Se presentan problemas de alimentación, deshidratación e insuficiencia renal. Además, la inestabilidad de la temperatura y la infección son comunes.4,2 En el caso presentado, se observaron todas las características descritas.
El diagnóstico prenatal sería el primer paso para la detección temprana de la enfermedad. Por lo tanto la obtención de la historia familiar, la consanguinidad entre los padres y la presencia de otros trastornos de la piel en la familia, serían muy útiles para el diagnóstico precoz de la enfermedad.4 Aunque sigue siendo difícil, pero es posible, mediante biopsia de piel fetal o ultrasonografía tridimensional. Aunque la ecografía podría no ser aplicable debido a la expresión fenotípica retrasada y la rareza de la enfermedad.6 También se debe realizar un análisis secuencial de la región de codificación del gen ABCA12 para identificar las mutaciones específicas que conducen al desarrollo de la ictiosis arlequín. Una vez la mutación se reconoce, los familiares también pueden ser seleccionados para el estudio portador.7
Tiene un pronóstico fatal en la mayoría de los casos durante el primer año de vida y la mayoría de las víctimas mueren a las pocas semanas de nacidos debido a complicaciones secundarias como infección y deshidratación.4 Sin embargo, la supervivencia está directamente relacionada con el tipo de mutaciones, es así como las víctimas con la mutación heterocigótica compuesta sobreviven más que aquellas con la mutación homocigoto8, además, con el cuidado intensivo neonatal avanzado en combinación con el manejo apropiado de la piel, muchos niños ahora sobreviven.9
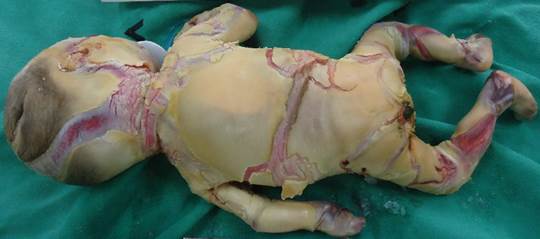
Figura 1. Estrato córneo engrosado, placas duras e inflexibles con fisuras rojas en estas que se extienden hasta la dermis.
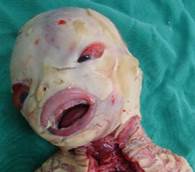
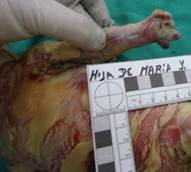
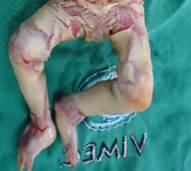
Figura 2. Ectropión, eclabium, hipoplasia de puente nasal y de los pabellones auriculares y deformidad en manos y pies con hipoplasia de uñas.
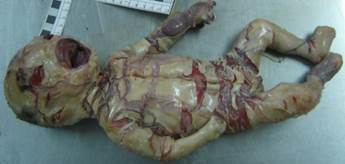
Figura. 4 Aspecto general de producto de primera gestación (2011).
Referencias
1. Salehin S, Azizimoghadam A, Abdollahimohammad A, Babaeipour-Divshali M. Harlequin ichthyosis: Case report. Journal of research in medical sciences : the official journal of Isfahan University of Medical Sciences. 2013;18(11):1004-5. Epub 2014/02/13.
2. Kelsell DP, Norgett EE, Unsworth H, Teh MT, Cullup T, Mein CA, et al. Mutations in ABCA12 underlie the severe congenital skin disease harlequin ichthyosis. American journal of human genetics. 2005;76(5):794-803. Epub 2005/03/10.
3. Harvey HB, Shaw MG, Morrell DS. Perinatal management of harlequin ichthyosis: a case report and literature review. Journal of perinatology: official journal of the California Perinatal Association. 2010;30(1):66-72. Epub 2009/12/30.
4. Richard G. Autosomal Recessive Congenital Ichthyosis. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Stephens K, et al., editors. GeneReviews((R)). Seattle (WA)1993.
5. Holden S, Ahuja S, Ogilvy-Stuart A, Firth HV, Lees C. Prenatal diagnosis of Harlequin ichthyosis presenting as distal arthrogryposis using three-dimensional ultrasound. Prenatal diagnosis. 2007;27(6):566-7. Epub 2007/03/28.
6. Hazuku T, Yamada K, Imaizumi M, Ikebe T, Shinoda K, Nakatsuka K, et al. Unusual protrusion of conjunctiva in two neonates with harlequin ichthyosis. Case reports in ophthalmology. 2011;2(1):73-7. Epub 2011/04/09.
7. Prendiville J. Harlequin Ichthyosis Medication. Medscape; 2016 [cited 2016 septiembre 4]; Available from: https://emedicine.medscape.com/article/1111503-medication.
8. Rajpopat S, Moss C, Mellerio J, Vahlquist A, Ganemo A, Hellstrom-Pigg M, et al. Harlequin ichthyosis: a review of clinical and molecular findings in 45 cases. Archives of dermatology. 2011;147(6):681-6. Epub 2011/02/23.
9. Craiglow BG. Ichthyosis in the newborn. Seminars in perinatology. 2013;37(1):26-31. Epub 2013/02/20.