REPORTE DE CASO
ANEMIA HEMOLÍTICA AUTOINMUNE POR ANTICUERPOS CALIENTES SECUNDARIA A HIPERTIROIDISMO. REVISIÓN DE LA LITERATURA
Fecha recibido: noviembre 9 de 2017
Fecha aceptado: noviembre 30 de 2017
William Rojas MDa, Adriana González MDb, Carlos Pérez MDc, Andrea Paola Guerrero MDc, Gilberto Jaramillo MDd, Maria Andrea Jaramillo MDe
Correo electrónico autor principal Dr. William Rojas: wrojas@fucsalud.edu.co
a Servicio de Endocrinología, Hospital de San José, Fundación Universitaria de Ciencias de la Salud, Bogotá DC, Colombia.
b Endocrinología, Fundación Universitaria de Ciencias de la Salud, Bogotá DC, Colombia.
c Hematología, Fundación Universitaria de Ciencias de la Salud, Bogotá DC, Colombia.
d Medicina Interna. Fundación Universitaria de Ciencias de la Salud. Bogotá DC, Colombia.
e Fundación Universitaria San Martin Cali, Colombia.
Resumen
La anemia hemolítica autoinmune (AHAI) es un trastorno con autoanticuerpos dirigidos contra los glóbulos rojos lo que acorta su supervivencia. Su etiología es diversa, puede ser idiopática o secundaria a consumo de medicamentos o a enfermedades autoinmunes. La fisiopatología exacta sigue sin estar clara en los casos en que se ha descrito secundaria a enfermedad tiroidea, siendo la mayoría de los pacientes hipertiroideos en el momento del diagnóstico de AHAI. Presentamos un caso con antecedente de AHAI idiopática con múltiples exacerbaciones, que ingresa por síntomas sugestivos de tirotoxicosis vs tormenta tiroidea, manejado con metimazol, propanolol, corticoides y colestiramina. Se concluye que el paciente desarrolló una AHAI secundaria a un hipertiroidismo, por lo que es importante evaluar las causas secundarias y realizar un seguimiento estricto debido al componente autoinmune de su enfermedad.
Palabras clave: anemia hemolítica autoinmune, autoinmunidad, hipertiroidismo, tratamiento.
© 2018 Fundación Universitaria de Ciencias de la Salud - FUCS.
Este es un artículo Open Access bajo la licencia CC BY-NC-ND (http:// creativecommons.org/licenses/by-nc-nd/4.0/).
Abastract
Autoimmune hemolytic anemia (AIHA) results from the formation of autoantibodies against red blood cells reducing their lifetime. Etiology of AIHA may be idiopathic, drug-induced or secondary to other autoimmune disorders. The pathophysiology of AIHA secondary to thyroid diseases remains unclear. Most patients have hyperthyroidism at the time of diagnosis of AIHA. We present a case of idiopathic AIHA with multiple exacerbations, who was admitted with symptoms suggestive of thyrotoxicosis or thyroid storm and was treated with methimazole, propranolol, corticoids and cholestyramine. We concluded the patient developed an AIHA secondary to hyperthyroidism, thus it is important to assess the secondary causes and conduct a close follow-up due to the autoimmune component of his disease.
Keywords: Autoimmune hemolytic anemia, autoimmunity, hyperthyroidism, treatment.
© 2018 Fundación Universitaria de Ciencias de la Salud - FUCS. This is an open access article under the CC BY-NC- ND license (http://creativecommons.org/licenses/by-nc- nd/4.0/).
Introducción
La anemia hemolítica autoinmune (AHAI) se caracteriza por la aparición de varios tipos de autoanticuerpos dirigidos contra los glóbulos rojos acortando su supervivencia.1 Se han estimado incidencias entre 1 en 35.000 y 1 en 80.000 de acuerdo con la población estudiada, constituyendo los anticuerpos calientes los causantes de 60 a 70% de los casos.2
Su etiología es diversa, puede ser idiopática, secundaria a una infección o medicamento, o bien asociada con otras patologías como linfomas de células B, enfermedades autoinmunes órganos específicos y sistémicos, enfermedad de Hodgkin o inmunodeficiencias. En forma mucho más rara se ha visto asociada con la enfermedad de Graves.3,4 La fisiopatología exacta no se entiende por completo pero parece estar relacionada con hipertiroidismo y autoinmunidad. Una hipótesis es que los autoanticuerpos del receptor de TSH reaccionan en forma cruzada con la superficie de los glóbulos rojos que conducen a AHAI, en especial porque el anticuerpo reactivo caliente es IgG. En algunos casos, la AHAI en el marco de la enfermedad de Graves ha sido tratada con éxito con medicamentos antitiroideos sin glucocorticoides, lo que hace hincapié en el papel del hipertiroidismo.3
A continuación se hace la descripción de un paciente con AHAI que acude al servicio de urgencias del Hospital de San José de Bogotá, con un cuadro de AHAI agudizado por hipertiroidismo.
Presentación de caso
Se trata de un paciente de sexo masculino que acude por presentar cuadro clínico de 3 días de evolución consistente en aparición de tinte ictérico generalizado asociado con astenia, ansiedad, náuseas, coluria y dolor abdominal tipo punzada localizado en hipocondrio derecho de intensidad 5/10, no irradiado. Como antecedente patológico cursa con anemia hemolítica autoinmune diagnosticada 10 meses antes, con 3 exacerbaciones posteriores que requirieron tratamiento con pulsos de esteroides y transfusión de 9 unidades de glóbulos rojos. Los estudios fueron negativos para síndrome de Evans, lupus eritematoso sistémico, hepatitis B y C, y tumores sólidos (tomografías de tórax y de abdomen normales). El manejo se siguió con prednisolona 50 mg/día, no adherente por falta de entrega de la medicación por su empresa de servicios médicos. Durante el interrogatorio manifestó intolerancia al calor, debilidad muscular, ansiedad y pérdida de peso de 14 kilogramos.
Dentro del examen físico se evidencia paciente longilíneo, tinte ictérico generalizado, hiperquinético, afebril, peso de 50 k, exoftalmos, escleras ictéricas y conjuntivas pálidas (figura 1). Presenta un bocio grado 3, difuso, consistencia blanda, no doloroso, signo de pemberton negativo, ruidos cardiacos taquicárdicos, abdomen distendido y hepatoesplenomegalia.
Se considera que cursa con una nueva exacerbación de anemia hemolítica autoinmune secundaria a posible hipertiroidismo, por la presencia de signos y síntomas de tirotoxicosis versus tormenta tiroidea. Se solicitaron exámenes paraclínicos enfocados para definir las características inmunológicas de los anticuerpos y su carácter secundario, cuyos resultados se ven en la tabla 1. De acuerdo con su interpretación se diagnostica anemia hemolítica autoinmune por anticuerpos calientes secundaria a hipertiroidismo. Se realiza escala de Burch y Wartofsky con un puntaje de 45, sugestiva de tormenta tiroidea. Se inicia manejo dirigido a bloqueo de la conversión periférica de T4 a T3 con metimazol 25 mg cada 12 horas vía oral, propanolol 40 mg via oral cada 12 h, dexametasona 8 mg endovenosa cada 8 h y colestiramina 1 g vía oral cada 12 horas. Dentro de su evolución hematológica se evidenció un ascenso en los niveles de hemoglobina y hematocrito y disminución de la hiperbilirrubinemia a expensas de la indirecta (tabla 1).
Discusión del caso y revisión de literatura
La AHAI se define como la destrucción eritrocítica secundaria a la presencia de anticuerpos dirigidos contra los antígenos propios de la membrana del eritrocito. La aproximación diagnóstica se hace con el cuadro hemático, con la disminución de los valores de hemoglobina y hematocrito, así como volúmenes normales, elevación de deshidrogenasa láctica, descenso de haptoglobina y aumento del conteo de reticulocitos. Es importante el apoyo con el análisis del frotis de sangre periférica para determinar presencia de esquistocitosis u otras enfermedades asociadas con deficiencias congénitas de las proteínas de la membrana del eritrocito. Por tanto, se debe abordar la presencia de anticuerpos calientes o fríos, y prueba de coombs directa.2,5
El sistema hematopoyético se ve afectado en los pacientes con hipertiroidismo y los cambios se pueden ver en los tres linajes de células sanguíneas6, aunque por lo general tienden a ser leves.7 La AHAI en el marco de la enfermedad de Graves (EG) puede ocurrir sola8-10 o asociada con púrpura trombocitopénica autoinmune, como parte del síndrome de Evan.4,11 Otros síndromes descritos que incluyen esta asociación, comprenden el de Basedow, desencadenado por la administración de yodo y el exceso de este en forma secundaria. También se han descrito casos inducidos por medios de contraste yodados, amiodarona, terapia con anticuerpos monoclonales y lugol.12-14
La fisiopatología exacta sigue sin estar clara, pero parece estar relacionada con hipertiroidismo y autoinmunidad, siendo en la mayoría de los casos hipertiroideos en el momento del diagnóstico de AHAI. De acuerdo con Naji P. y col15, señalan al proceso de autoinmunidad como el mecanismo subyacente probable y postulan “que el aumento de la actividad tiroidea en los pacientes con hipertiroidismo es también un resultado directo del aumento de la autoinmunidad en la EG”.
En los casos de tormenta tiroidea se vió que la relación T3L/T4 estaba inversamente relacionada con la severidad de los síntomas y el puntaje APACHE II, lo cual indica que pareciera estar suprimida la conversión en estos pacientes.16 Esta condición puede ser potencialmente mortal, debido a lo difícil de tratar incluso cuando el diagnóstico se hace de manera oportuna. La presentación clínica clásica incluye hiperpirexia, taquicardia, diarrea, vómito, insuficiencia cardíaca y alteración del estado mental. La escala de Burch-Wartofsky se utiliza para hacer el diagnóstico; en nuestro paciente, la puntuación estuvo en el límite inferior para apoyar el diagnóstico de tormenta tiroidea.5
El tratamiento consiste en la terapia antitiroidea con medicamentos como metimazol y propiltiouracilo que inhiben la tiroides a nivel de la peroxidasa evitando el acople de yodotirosina en moléculas de tiroglobulina, lo cual conlleva a la síntesis reducida de hormona tiroidea. El propiltiouracilo inhibe la desyodinasa tipo I logrando una disminución en forma aguda de triyodotironina mayor que con el metimazol. A pesar de lograrse una acción más rápida, el propiltiouracilo tiene mayor riesgo de hepatotoxicidad por lo cual se prefiere metimazol según recomienda la Asociación Americana de Tiroides. El tiempo en lograr el eutiroidismo es variable; cuando se consigue, se debe continuar con seguimiento por cerca de 18 a 24 meses.17 Otros medicamentos que pueden utilizarse, como la solución de lugol la que inhibe la oxidación y organificación de yoduro, cuyo efecto puede durar de 1 a 2 semanas luego de suspenderla, se reserva para casos de tormenta tiroidea.17 En esta última situación se indican corticoides los cuales inhiben la síntesis de hormonas tiroideas y el paso periférico de T4 a T3. Se ha demostrado en varias publicaciones que con el control del estado hipertiroideo es posible la remisión de la crisis hemolítica.1,2,9,14,18 La plasmaféresis es otra opción de tratamiento teniendo en cuenta que se trata de una enfermedad autoinmune en donde se logra remover el exceso de citoquinas, antiTrab, con mejoría temprana en la fase aguda. Es una opción para los pacientes con enfermedad refractaria al manejo o intolerancia a los antitiroideos.17
La solución yodada (yodo 131) se aplica en dosis única de 20 a 30 milicurios con respuesta en 3 a 6 semanas. Por lo general se utiliza en conjunto con esteroides. En los casos de tormenta tiroidea se recomienda su uso después de antitiroideos para lograr la normalización rápida del perfil hormonal y la disminución de complicaciones.16
La plasmaferesis debe considerarse en pacientes con anemia hemolítica previa asociada con crisis hemolítica en estado de falla multiorgánica. Una publicación19 reportó su uso en pacientes que cursaron con trombocitopenia hemolítica y anemia hemolítica autoinmune. Así mismo, se usa cuando no hay mejoría clínica en casos de tormenta tiroidea posterior a 48 horas de observación.3
El uso de corticoides se ha recomendado por el estado de insuficiencia adrenal asociado con la tormenta tiroidea. Se ha demostrado un efecto coadyuvante en la inhibición de la síntesis de la hormona tiroidea, así como la conversión periférica.20 Los betabloqueadores deben usarse como el propanolol para controlar los efectos cardiovasculares del estado hipertiroideo. Hay recomendación alta en guías de práctica clínica para el uso del mismo.17
El caso estudiado presentó mejoría con el esquema de metimazol, propanolol y corticoide endovenoso, sin necesidad de medicación adicional, con normalización de cuadro hipertiroideo, restitución del componente hematológico y disminución de bilirrubinas. Esto puede explicarse por el manejo agudo del cuadro y la rapidez en la atención del servicio de urgencias.
Conclusiones
La asociación entre el estado hipertiroideo y la anemia hemolítica autoinmune es una situación rara, sin embargo ante esta presentación clínica deben descartarse las condiciones desencadenantes del estado hipertiroideo, como son neoplasias, afecciones autoinmunes o de origen farmacológico. El tratamiento depende del estado de compromiso del paciente siguiendo el manejo con antiinflamatorios sistémicos y antitiroideos. Cuando ocurra trombocitopenia se debe considerar plasmaféresis. En este caso el paciente presenta una AHAI secundaria a hipertiroidismo, ocurriendo primero la anemia que el cuadro tiroideo, por lo que es importante siempre la evaluación de esta causa secundaria y seguir un estricto margen de seguimiento debido al componente autoinmune de su enfermedad.
![]()
![]()
![]()
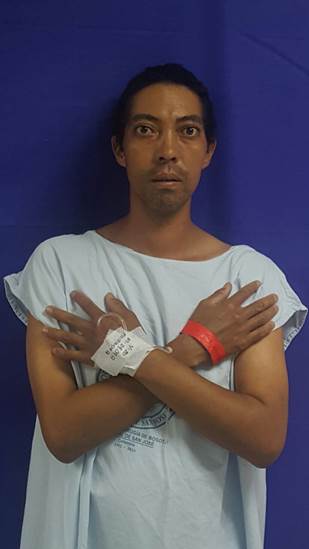

Figura 1. Se observa paciente longilineo con tinte ictérico generalizado, claro exoftalmos y escleras ictéricas.
Tabla 1. Resultado de exámenes paraclínicos
|
Paraclínico |
Valor ingreso |
Control |
|
Ácido fólico |
18.8 ng/ml |
No realizado |
|
Anticuerpos antimicrosomales y antitiroglobulina |
Positivos |
No realizado |
|
Bilirrubina directa |
5.7 mg/dl |
4.5 mg/dl |
|
Bilirrubina indirecta |
9.3 mg/dl |
3.3 mg/dl |
|
Bilirrubina total |
15 mg/dl |
1.2 mg/dl |
|
BUN |
18 mg/dl |
No realizado |
|
Coombs directo |
+++ |
No realizado |
|
Coombs fraccionado |
IgG3 |
No realizado |
|
Creatinina |
0,6 mg/dl |
No realizado |
|
Ecografía abdominal total |
Hepatomegalia |
No realizado |
|
Hemograma |
Leucocitos 7800, neutrófilos 6300, linfocitos 1000, hb 6.3 g/dl, hct 18.9 %, vcm 97,3 fl, hcm 32,0 pg, plaquetas 212 000 |
Leucocitos 10600, neutrófilos 8200, linfocitos 1050, hb 9,8 g/dl, hct 29.8 %, vcm 99,3 fl, hcm 32,6 pg, plaquetas 235 000 |
|
LDH |
712 U/L |
No realizado |
|
Reticulocitos |
13.2% |
No realizado |
|
T4L |
>90.0 pmol/L |
No realizado |
|
TGO |
24 U/L |
No realizado |
|
TGP |
24 U/L |
No realizado |
|
TSH |
<0.015 uUI/ml |
No realizado |
|
VDRL |
NO REACTIVA |
No realizado |
|
VIH |
NEGATIVO |
No realizado |
|
Vitamina B 12 |
474 pg/ml |
No realizado |
Referencias
1. Lee FY, Ho CH, Chong LL. Hyperthyroidism and Evans' syndrome. A case report. Taiwan yi xue hui za zhi Journal of the Formosan Medical Association. 1985;84(2):256-60.
2. Gehrs BC, Friedberg RC. Autoimmune hemolytic anemia. American journal of hematology. 2002;69(4):258-71.
3. Ogihara T, Katoh H, Yoshitake H, Iyori S, Saito I. Hyperthyroidism Associated with Autoimmune Hemolytic Anemia and Periodic Paralysis: A report of a case in which antihyperthroid therapy alone was effective against hemolysis. Japanese Journal of Medicine. 1987;26(3):401-3.
4. Ushiki T, Masuko M, Nikkuni K, Terukina-Yoshida J, Momotsu-Nanba A, Morikawa H, et al. Successful remission of Evans syndrome associated with Graves' disease by using propylthiouracil monotherapy. Internal Medicine. 2011;50(6):621-5.
5. Valent P, Lechner K. Diagnosis and treatment of autoimmune haemolytic anaemias in adults: a clinical review. Wiener klinische Wochenschrift. 2008;120(5-6):136-51.
6. Ford HC, Carter JM. The haematology of hyperthyroidism: abnormalities of erythrocytes, leucocytes, thrombocytes and haemostasis. Postgraduate Medical Journal. 1988;64(756):735-42.
7. Orwoll ES, Orwoll RL. Hematologic abnormalities in patients with endocrine and metabolic disorders. Hematology/oncology clinics of North America. 1987;1(2):261-79.
8. Chiang E, Packer CD. Concurrent reactive arthritis, Graves' disease, and warm autoimmune hemolytic anemia: a case report. Cases journal. 2009;2(1):6988.
9. Chee YC, Gill DS, Poh SC. Hyperthyroidism and autoimmune hemolytic anemia--a case report. The Medical journal of Malaysia. 1978;33(2):154-5.
10. O’Brien D, Lyons DJ, Fielding JF. A case of Graves’ disease associated with autoimmune haemolytic anaemia. Irish journal of medical science. 1989;158(6):155.
11. Yashiro M, Nagoshi H, Kasuga Y, Isobe H, Kitajima S, Nakagawa T, et al. Evans' syndrome associated with Graves' disease. Internal medicine. 1996;35(12):987-90.
12. El-Shirbiny AM, Stavrou SS, Dnistrian A, Sonenberg M. Jod-Basedow syndrome following oral iodine and radioiodinated-antibody administration. The Journal of Nuclear Medicine. 1997;38(11):1816-7.
13. Kuroda H, Kida M, Watanabe H, Matsunaga T, Niitsu Y, Matsumoto M. Basedow disease associated with Evans syndrome. [Rinsho ketsueki] The Japanese journal of clinical hematology. 2005;46(10):1118-22.
14. Arpin MP, Alt M, Kheiralla JC, Chabrier G, Welsch M, Imbs JL, et al. Hyperthyroidism and immune hemolytic anemia following amiodarone therapy. La Revue de medecine interne. 1991;12(4):309-11.
15. Naji P, Kumar G, Dewani S, Diedrich WA, Gupta A. Graves’ disease causing pancytopenia and autoimmune hemolytic anemia at different time intervals: a case report and a review of the literature. Case reports in medicine. 2013;2013.
16. Isozaki O, Satoh T, Wakino S, Suzuki A, Iburi T, Tsuboi K, et al. Treatment and management of thyroid storm: analysis of the nationwide surveys. Clinical endocrinology. 2016;84(6):912-8.
17. Satoh T, Isozaki O, Suzuki A, Wakino S, Iburi T, Tsuboi K, et al. 2016 Guidelines for the management of thyroid storm from The Japan Thyroid Association and Japan Endocrine Society. Endocrine journal. 2016;63(12):1025-64.
18. Branehög I, Olsson KS, Weinfeld A, Domellöf L. Association of hyperthyroidism with idiopathic thrombocytopenic purpura and haemolytic anaemia. Journal of Internal Medicine. 1979;205(1‐6):125-31.
19. Geissler D, Ogriseg M, Fill H, Wolf H. Plasmapheresis treatment in 3 simultaneously occurring autoimmune diseases: Hashimoto thyroiditis with hyperthyroidism, autoimmune thrombopenia and autoimmune hemolytic anemia. Wiener klinische Wochenschrift. 1987;99(10):351-5.
20. Bianco AC, Nunes MT, Hell NS, Maciel RM. The role of glucocorticoids in the stress-induced reduction of extrathyroidal 3, 5, 3′-triiodothyronine generation in rats. Endocrinology. 1987;120(3):1033-8.